ऊष्माशोषी अभिक्रिया के लिए सक्रियण ऊर्जा होती है
ऋणात्मक
धनात्मक
शून्य
ज्ञात नहीं की जा सकती
The correct Answer is:B
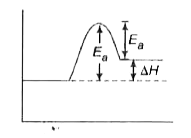
ऊष्माशोषी अभिक्रिया के लिए ,अतः ऊष्माशोषी अभिक्रिया के लिए सक्रियण ऊर्जा का मान धनात्मक होता है।
∴ E1=Ea,+ΔH
अतः Ea>ΔH
Similar Questions
दी गई अभिक्रिया में, अग्र अभिक्रिया के लिए सक्रियण ऊर्जा (E_a)_f का मान 80 kJmol^(-1) है तथा DeltaH = -40 kJmol^(-1) है। एक उत्प्रेरक, सक्रियण ऊर्जा (E_a)_f " को " 20 kJmol^(-1) तक कम करता है। उत्प्रेरक के योग से पहले तथा बाद में, उत्क्रमणीय अभिक्रिया के लिए सक्रियण ऊर्जा का अनुपात है:
View Solutionएक अभिक्रिया के लिए सक्रियण ऊर्जा क्या है, जब तापमान 20∘C से 35∘C तक बढ़ाया जाता है और इसकी दर दोगुनी हो जाती है? (R=8.314Jmol−1K−1 )
View Solutionएक अनउत्प्रेरित अभिक्रिया के लिए सक्रियण ऊर्जा 100 kJ mol^(-1) है। उत्प्रेरक की उपस्थिति सक्रियण ऊर्जा को 75% तक कम कर देती है। 27^@C पर उत्प्रेरित और अनउत्प्रेरित अभिक्रियाओं के दर स्थिरांक के अनुपात का "log"_(10)(K_2)/(K_1) है? मान लीजिए दोनों अभिक्रियाओं के लिए आवृत्ति गुणांक समान है। (दिया है 2.303 xx 8.314 = 19.147 )
View Solutionजब जैव-रासायनिक अभिक्रिया को एंजाइम की अनुपस्थिति में मानव शरीर के बाहर प्रयोगशाला में किया जाता है, तो प्राप्त अभिक्रिया का वेग 10^(-6) गुना प्राप्त होता है, एंजाइम की उपस्थिति में अभिक्रिया की सक्रियण ऊर्जा है:
View Solutionमाना कि प्रत्येक अभिक्रिया एक खुले पात्र में होती है। किस अभिक्रिया के लिए, DeltaH = DeltaE होगा?
View Solutionएक अभिक्रिया की सक्रियण ऊर्जा शून्य है। अभिक्रिया का दर नियतांक (k):
View Solutionनिम्नलिखित में से किस संक्रमण के लिए ऊर्जा की अधिकतम मात्रा की आवश्यकता होती है?
View Solutionसक्रियण ऊर्जा, E_(a1) = 180 "kJ/mol", E_(a2) = 80 "kJ/mol" और E_(a3) = 50 "kJ/mol" के साथ तीन चरणों में एक अभिक्रिया होती है। अभिक्रिया का सम्पूर्ण दर स्थिरांक, k = [(k_(1)k_(2))/k_(3)]^(2//3) अभिक्रिया की सक्रियण ऊर्जा होगी-
View Solution
