0.10MNH3 विलयन की pH गणना ज्ञात कीजिए इस विलयन . के 50ml को 0.10 M के HCI के 25.0 mL से अभिक्रिया करवाने पर pH की गणना कीजियेः अमोनिया का वियोजन स्थिरांक Kb=1.77×10−5
NH3+H2O→NH+4+OH−
Kb=[NH+4][OH−][NH4OH]
[NH+4]=[OH−]=x
[NH3]=0.10−x=.10
Kb=x2[NH3]=x2.10=1.77×10−5
x2=.10×1.77×10−5=1.77×10−6
x=1.33×10−3
x=1.33×10−3
[H+]=Kw[OH−]=10−141.33×10−3=7.51×10−12
pH=−log(7.5+10−12)=11.12
25mL 0.1 MHCI विलयन (अर्थात् 2.5 मि.मोल HCI) को 50 mL 0.1 MNH3 विलयन (अर्थात् 5 मि. मोल NH3 ) में मिलाने पर 2.5 मि.मोल NH, उदासीन हो जाती है। अतः 75 mL मिश्रण में 2.5 मि. मोल NH+4 आयन और 2.5 मि.मोल अउदासीनीकृत NHI रह जाती है।
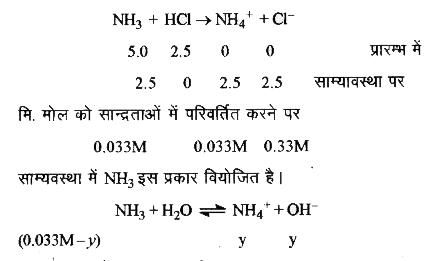
मि. मोल को सान्द्रताओं में परिवर्तित करने पर
अतः विलयन में कुल NH+4 की सान्द्रता = 0.033+y चूंकि y का मान कम है -
अतः [NH+4]=0.033M,[OH−]=y
NH4OH]=0.033M
Kb=[NH+4][OH−]/[NH4OH]
=0.033×y0.33=1.77×10−5
∴[OH−]=1.77×10−5
[H+]=10−141.77×10−5
=5.6×10−10
pH=10−log5.6
=9.24
Similar Questions
pH=2 वाले HCI विलयन 4 ml को p H=12 विलयन के 6 ml के साथ मिलाया जाता है। विलयन की परिणामी pH क्या होगी?
View SolutionpH = 3.0 वाले HCI विलयन के 2.0 ml और pH से निर्मित विलयन का pH है:
View Solution0.25 M विलयन का 250 ml निर्मित करने के लिए आवश्यक निर्जल Na_(2)CO_(3) के द्रव्यमान की गणना कीजिए।
View Solutionएक दुर्बल अम्ल HX का वियोजन स्थिरांक 1 xx 10^(-5) M है। यह क्षार के साथ अभिक्रिया पर एक लवण Nax का निर्माण करता है। Nax के 0.1 M विलयन के जल अपघटन की मात्रा है
View Solution50 ml जल के साथ 0.01MBa(OH)2 विलयन के 50 ml को मिलाने से प्राप्त विलयन के pH की गणना कीजिए।
View Solution1 M NaOH विलयन के 2.5 लीटर और 0.5M NaOH के 3 लीटर विलयन के मिश्रण द्वारा प्राप्त परिणामी विलयन की मोलरता की गणना कीजिए।
View Solution69^(@)C पर वायुमंडल में ईक्षु शर्करा के 10% विलयन के परासरण दाब की गणना कीजिए।
View Solution0.5(M) HCI के 750 mL को 2(M) HCI के 250 mL के साथ मिश्रित करने पर प्राप्त विलयन की मोलरता क्या होगी?
View Solution

