प्रक्कथनः मानक अपचयन विभव के ऋणात्मक मान में तात्पर्य हे कि मानक हाइड्रोजन इलेक्ट्रोड के संदर्भ में अपचयन इस इलेक्ट्रोड पर हो रहा है।
कारणः अर्द्ध सेल के मानक इलेक्ट्रोड विभव का निश्चित मान होता है
प्रक्कथन और कारण दोनों सही है और कारण प्रक्कथन का सही स्पष्टीकरण देता है।
प्रक्कथन और कारण दोनों सही हैं किंतु कारण प्रक्कथन का सही स्पष्टीकरण नहीं देता है
प्रक्कथन सही है किंतु कारण गलत है
प्रक्कथन गलत है किंतु कारण सही है
The correct Answer is:D
मानक अपचयन विभव के ऋणात्मक मान का तात्पर्य है कि मानक हाइड्रोजन इलैक्ट्रोड के संदर्भ में इस इलेक्ट्रोउ पर ऑक्सीकरण हो रहा है।
समान प्रश्न
चार धातुओं A, B, C और D के मानक इलेक्ट्रोड विभव (E_(M^(+)//M)^(@)) क्रमश: –1.2 V, 0.6 V, 0.85 V और -0.76 V हैं। विभव लगाने पर धातुओं के निक्षेपण का अनुक्रम है:
View Solutionएकल इलेक्ट्रोड के लिए, 298 K पर मानक अपचयन विभवों के मान नीचे दिए गए है -
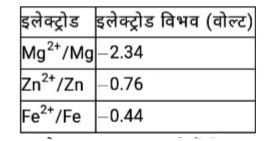
इससे हम यह बता सकते हैं कि
View Solutionमानक हाइड्रोजन इलेक्ट्रोड के साथ Cl_(2)//Cl^(-) (aq) अर्द्ध सेल के संयोजन से निर्मित सेल का मानक विभव +1.36V और ((delE^(@))/(delT))_(P)=1.2xx10^(-3)VK^(-1) है। अभिक्रिया H_(2(g))+Cl_(2(g))to2H_((aq))^(+)+2Cl_((aq))^(-) के लिए DeltaS_("अभिक्रिया")^(@) का मान क्या है?
View Solutionसेल के साम्य स्थिरांक और मानक अपचयन विभव के मध्य सही संबंध कौन सा है?
View Solutionतीन धातुओं A, B और C के मानक अपचयन इलेक्ट्रॉड विभव क्रमशः + 0.5V, - 3.0V तथा 1.2 V है। इन धातुओं की अपचयन क्षमता का क्रम है:
View Solutionदो अर्ध सेलों के दिए गए मानक इलेक्ट्रोड विभव से Fe++2e−Fe,E∘=−0.440V
Fe+++3e−→Fe,E∘=−0.036V निम्न के लिए मानक इलेक्ट्रोड विभव (E∘) की गणना कीजिए
F+++e−→Fe++
View Solutionएक मानक हाइड्रोजन इलेक्ट्रॉड का विभव शून्य होता है क्योंकि
View Solutionजब E_1^@ और E_2^@ के इलेक्ट्रोड विभव वाले दो अर्ध-सेल संयोजित होकर इलेक्ट्रोड विभव E_3^@ ( n_1, n_2, n_3 प्रथम, द्वितीय और तृतीय अर्ध-सेल अभिक्रियाओं में विनिमय इलेक्ट्रोड की संख्या है) वाले एक सेल का निर्माण करते हैं, तब:
View Solution

