यदि Cu2+/Cu इलेक्ट्रोड का मानक विभव 0.34 वोल्ट हो, तो Cu2+ का 0.01 M सांद्रता पर इलेक्ट्रोड विभव क्या है? (T = 298 K)
0.399 वोल्ट
0.281 वोल्ट
0.222 वोल्ट
0.176 वोल्ट
The correct Answer is:B
Cu2++2e−→Cu
E=E∘−0.05912log1[Cu2+]
=0.34−0.05912log100
=0.34−0.0591=0.281 वोल्ट
समान प्रश्न
गैल्वेनिक सेल, इलेक्ट्रोड विभव, SHE, मानक इलेक्ट्रोड विभव, संक्रियता श्रेणी |नर्न्स्ट समीकरण |Summary
View Solutionसेल विभव तथा मानक इलेक्ट्रोड विभव
View Solution2 cells Cd|Cd^(2+)||Cu^(2+)|Cu Calculate the standard world-value of K and determine the cell reaction. (E_(Cu^(2+)//Cu)^@=0.34" वोल्ट", E_(Cd^(2+)//Cd)^@=-0.403"वोल्ट")
View Solutionचार धातुओं A, B, C और D के मानक इलेक्ट्रोड विभव (E_(M^(+)//M)^(@)) क्रमश: –1.2 V, 0.6 V, 0.85 V और -0.76 V हैं। विभव लगाने पर धातुओं के निक्षेपण का अनुक्रम है:
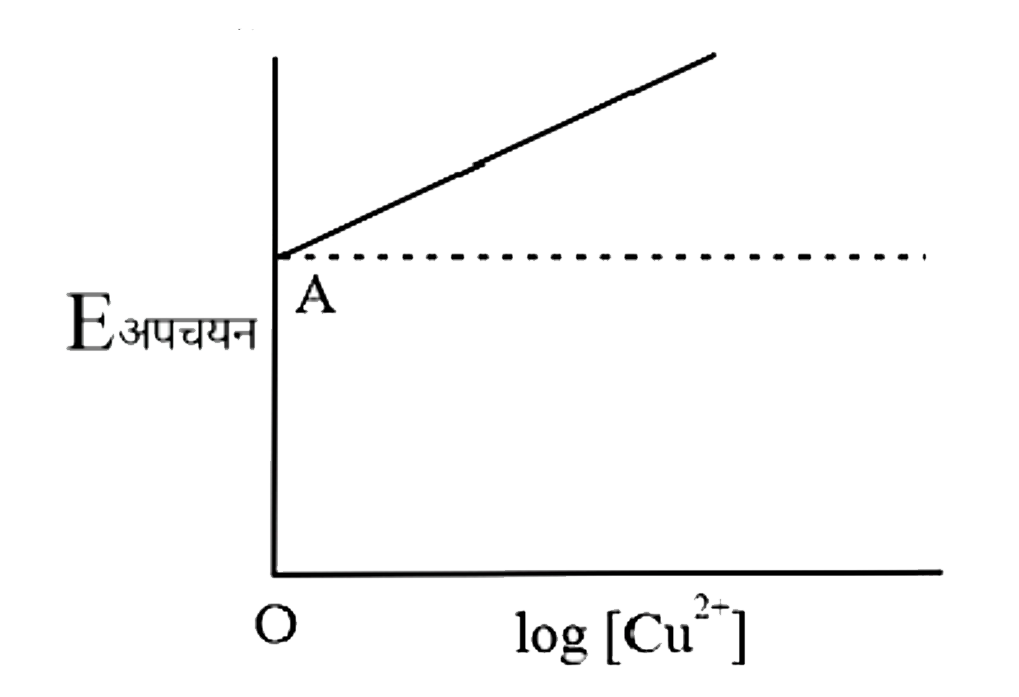
View Solutionनीचे, अभिक्रिया Cu2++2e−→Cu के लिए Eअपचयन के मध्य आलेख दर्शाया गया है, जहां OA = 0.34 V है, तब Cu∣Cu2+(0.1M) के अर्ध सेल का इलेक्ट्रोड विभव कितना होगा?
View Solutionएक मानक हाइड्रोजन इलेक्ट्रॉड का विभव शून्य होता है क्योंकि
View Solutionसाम्यावस्था पर निम्नलिखित अभिक्रिया पर विचार कीजिए, 2Fe^(2+) (aq) + Cu^(2+) to 2Fe^(3+) (aq)+Cu जब अभिक्रिया साम्यावस्था में आती है, तो सेल विभव क्या है?
View Solutionजब E_1^@ और E_2^@ के इलेक्ट्रोड विभव वाले दो अर्ध-सेल संयोजित होकर इलेक्ट्रोड विभव E_3^@ ( n_1, n_2, n_3 प्रथम, द्वितीय और तृतीय अर्ध-सेल अभिक्रियाओं में विनिमय इलेक्ट्रोड की संख्या है) वाले एक सेल का निर्माण करते हैं, तब:
View Solution
