Why fluorine shows-1 oxidation state only whereas other halogens show variable oxidation states ?Solution in Punjabi
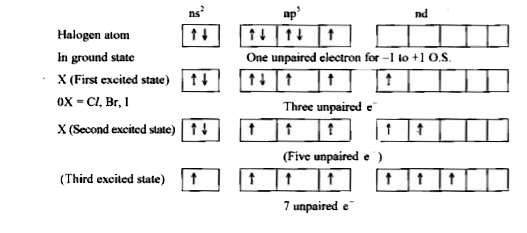
Fluorine is the most electronegative element and cannot exhibit any positive oxidation state. Other halogens have d-orbitals and therefore can show excited states as shown below to show +1, +3, +5 and +7 oxidation states also.
Topper's Solved these Questions
- SOLVED MODEL TEST PAPER-2Book:ACCURATE PUBLICATIONChapter:SOLVED MODEL TEST PAPER-2Exercise:SECTION D
Explore 11 Videos
- SOLVED MODEL TEST PAPER-2Book:ACCURATE PUBLICATIONChapter:SOLVED MODEL TEST PAPER-2Exercise:SECTION B
Explore 16 Videos
- SOLVED MODEL TEST PAPER-1Book:ACCURATE PUBLICATIONChapter:SOLVED MODEL TEST PAPER-1Exercise:SECTION D
Explore 14 Videos
- SOLVED MODEL TEST PAPER-3Book:ACCURATE PUBLICATIONChapter:SOLVED MODEL TEST PAPER-3Exercise:SECTION D
Explore 12 Videos
Similar Questions
Explain Swarts reaction.
View SolutionZn and Cd are not normally considered as transition metals. Why ?
View SolutionWrite the following reaction:
Wurtz Fittig Reaction
View SolutionExplain the following reactions:
Balz Schiemann reaction.
View SolutionFluorine does not show variable oxidation states while other members of the halogen family exhibit variable oxidation states. Why ?
View SolutionFluorine exhibits only -1 oxidation state whereas other halogens show +1, +3, +5 and +7 oxidation states also. Explain.
View Solutionफ्लुओरीन केवल −1 ऑक्सीकरण अवस्था प्रदर्शित करता है जबकि अन्य हैलोजन +1,+3,+5 तथा +7 ऑक्सीकारक अवस्थाएँ भी प्रदर्शित करते है? व्याख्या कीजिए।
View Solutionफ्लुओरीन केवल +1 या −1 ऑक्सीकरण अवस्था दर्शाता हैं जबकि अन्य हैलोजन तत्व इसके अतिरिक्त +3,+5 एवं +7 ऑक्सीकरण अवस्था भी दर्शाती हैं, क्यों?
View SolutionUnlike other halogens Fluorine does not show higher oxidation states because
View SolutionFluorine exhibits only -1 oxidation state whereas other halogens show +1, +3, +5 and +7 oxidation states also. Explain.
View Solutionफ्लुओरीन केवल -1 ऑक्सीकरण अवस्त्था ही दर्शाता है , क्यों ?
View Solutionफ्लुओरीन केवल - 1 ऑक्सीकरण अवस्था दर्शाता है जबकि अन्य हैलोजेन तत्व इसके अतिरिक्त + 3, + 5 एवं + 7 ऑक्सीकरण अवस्था भी दर्शाति हैं, क्यों ?
View Solutionफ्लूओरीन केवल - 1 ऑक्सीकरण अवस्था दर्शाता है, जबकि अन्य हैलोजेन तत्व इसके अतिरिक्त + 3, + 5 एवं + 7 ऑक्सीकरण अवस्था भी दर्शाते हैं, क्यों ?
View SolutionFluorine exhibit only – 1 oxidation state whereas other halogens exhibit +ve oxidation states also. Explain why ?
View Solutionफ्लुओरीन केवल -1 ऑक्सीकरण अवस्था प्रदर्शित करता है जबकि अन्य हैलोजन तत्त्व+1, +3, +5 तथा +7 ऑक्सीकरण अवस्थायें भी प्रदर्शित करता है। व्याख्या कीजिये।
View SolutionFluorine exhibits only - 1 oxidation state , whereas other halogens exhibit +1,+3,+5and+7 oxidation states . Explain.
View Solution
